
Proud to be Chemist
STOIKIOMETRI
Massa Atom Relatif dan Massa Molekul Relatif
-
Massa Atom Relatif
Kita bisa mencari massa atom relatif suatu unsur dari tabel periodik. Massa satu atom tidak dapat dicari dengan menimbangnya karena sangat kecil. Oleh karena itu, para ahli menggunakan skala massa atom relatifnya, dengan membandingkan massa atom tersebut dengan massa atom pembanding. Atom yang dijadikan sebagai pembanding adalah atom karbon (C-120). Jadi, massa atom relatif (Ar) adalah perbandingan massa rata-rata 1 atom dengan massa 1 atom C-12.

Contoh Soal
Di alam, unsur klorin mempunyai dua isotop, yaitu Cl-35 (kelimpahan 75,53%, massanya 34,969 sma) dan Cl-37 (kelimpahan 24,47%, massanya 36,966 sma). Tentukan Ar dari unsur klorin!

2. Massa Molekul Relatif
Massa molekul relatif (Mr) menyatakan perbandingan 1 molekul suatu senyawa dengan massa 1 atom C-12. Sehingga Mr suatu molekul sama dengan jumlah semua Ar dari semua atom penyusunnya.
Contoh Soal
Hitungah massa molekul relatif dari senyawa C2H5OH. Jika diketahui Ar H=1, C=12, O=16
Jawab: Mr C2H5OH= (2 x Ar C) + (6 x Ar H) + (1 X Ar O)
= (2 x 12) + (6 x 1) + (1 X 16)
= 46

Persamaan Reaksi
Persamaan reaski adalah penulisan simbolik dari suatu reaksi kimia. Pada reaksi kimia tidak terjadi perubahan massa zat, karena dalam reaksi kimia hanya terjadi penyusunan kembali atom-atom zat yang bereaksi.
Dalam suatu persamaan reaksi,
-
Zat yang berada di sebelah kiri anak panah adalah zat yang bereaksi atau pereaksi/reaktan.
-
Zat yang di sebelah kanan anak panah adah zat hasil reaksi atau produk
-
Huruf dalam tanda kurung menyatakan wujud zat
s (solid) : padat
g (gas) : gas
l (liquid) :cair
aq (oqueous) : larutan dalam air
-
Agka dibelakang zat disebut indeks
-
Angka di depan disebut koefisien reaksi
-
Persamaan yang sudah mempunyai koefisien yang sesuai disebut setara
Untuk lebih memahaminya, perhatikan video yang diambil dari salah satu situs youtube berikut.
Hukum-Hukum Dasar Kimia
1. Hukum Lavoisier (Hukum Kekelakan Massa)
Pada tahun 1789, kimiawan prancis bernama Antoine Laurent Lavoisier melakukan percobaan dengan memanaskan logam raksa dalam tabung tertutup semala 12 hari dan menghitung perubahan volume udara dalam tabung tersebut. Ternyata logam raksa bereaksi dalam tabung dengan zat dari udahra yang diberi nama oksigen.
Lavoisier melakukan percobaan lagi dengan menggunakan 530 gram logam raksa yang dibakar di tabung tertutup. Pembakaran ini menghasilkan 572,4 gram raksa(II) oksida dan udara di dalam tabung berkurang sebanyak 42,4 gram, sehungga persamaannya adalah sebagai berikut:
Raksa + Oksigen - > Raksa(II) oksida
530 gram 42,4 gram 572,4 gram
Dari percobaan tersebut ternyata massa sebelum dan sesudah reaksi itu sama. Sehingga Lavoisier menyimpulkan hasil penemuannya ini dengan Hukum Kekekalan Massa, yang berbunyi:
“Dalam sistem tertutup, massa zat sebelum dan sesudah reaksi adalah sama.”
Namun, biasanya reaksi yang kita amati berlangsung pada sistem terbuka, sehingga zat ada yang berubah menjadi gas, dan seolah-olah massanya berkurang, seperti pada contoh berikut:
HgO (s) - > Hg (s) + O2 (g)

2. Hukum Proust (Hukum Perbandingan Tetap)

Berdasarkan penelitian yang dilakukan oleh Joseph Louis Proust pada tahun 1799, menunjukkan bahwa tembaga(II) karbonat. CuCO3, baik berasal dari sumber alam maupun sinesis mempunyai susunan yang tetap.
Dari percobaan ini, ia menyatakan bahwa. Senyawa yang sama, darimanapun asalnya, kapanpun dan bagaimanapun pembuatannya akan mempunyai komposisi yang sama.
Misalnya, 2 gram garam dari Jakarta mengandung Na sebanyak 0,786 gram dan Cl 12,14 gram. Sehingga, perbandingan massa Na dan Cl adalah 1:1,54. Garam dari yogyakarta pun, dari 1,5 gram mengandung 0.59 gram dan Cl sebanyak 0,91 gram. Sehingga, perbandingan massa Na dan Cl juga 1:1,54.
Contoh Soal
Dalam besi(II) sulfida, perbandingan antara massa besi dan belerang adalah 7 : 4. Berapa gram besi(II) sulfida yang terbentuk dan zat apa yang masih tersisa jika17 gram besi direaksikan dengan 8 gram belerang?
Jawab:
Besi + Belerang - > Besi(II) sulfida
Perbandingan massa : 7 4
Massa zat mula-mula: 17 gram 8 gram -
Massa zat bereaksi : 14 gram 8 gram
Massa zat terbentuk : 22 gram
Massa zat sisa: 3 gram
Jadi, massa besi(II) sulfida yang terbentuk adalah 22 gram, sedangkan zat yang tersisa adalah besi sebanyak 3 gram.
3. Hukum Dalton (Hukum Kelipatan Berganda)
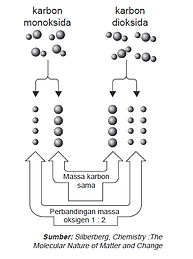
John Dalton mengemukakan salah satu hukum dasar kimia yaitu Hukum Kelipatan berganda. Hukum ini berkaitan dengan pasangan unsur yang dapat membentuk lebih dari satu senyawa. Misalnya C dan O bisa membentuk CO dan CO2.
Bila unsur-unsur dapat membentuk dua macam senyawa atau lebih, untuk massa salah satu unsur sama maka massa unsur kedua dalam masing-masing senyawa berbanding sebagai bilangan bulat dan sederhana.
Contoh Soal
Perbandingan massa N dan O dalam senyawa NO dan NO2 adalah sebagai berikut:


Buktikan apakah kedua rumus senyawa tersebut memenuhi Hukum Kelipatan Perbandingan?
Jawab: Jika massa N pada senyawa NO disamakan dengan massa N
pada NO2 yaitu 28, maka massa O pada NO dapat dihitung sebagai berikut:
28/21 x 24 gram = 32 gram
Sehingga perbandingan menjadi:
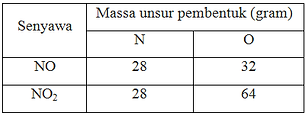
Dari perbandingan ini untuk perbandingan massa N yang sama ternyata perbandingan massa oksigennya 32 : 64 atau 1 : 2 yang merupakan bilangan bulat dan sederhana.
Jadi, kedua rumus ini memenuhi Hukum Kelipatan Perbandingan
4. Hukum Gay Lussac (Hukum Perbandingan Volume)
Henry Cavendish (1731-1810) mengemukakan bahwa dalam suhu dan tekanan yang sama. Perbandingan hidrogen dan oksigen dama membuat air adalah 2:1. Dan Joseph Louis Gay Lussac tertaric pada pertanyaan ini kemudian ia melakukan percobaan dengan berbagai gas dan menemukan bahwa:
-
Pada reaksi antara gas hidrogen dengan gas klorin dalam membentuk gas hidrogen klorida, perbandingan volumenya adalah 1:1:2
gas hidrogen + gas klorida - > gas hidrogen klorida
(V liter) (V liter) (2V liter)

-
Pada reaksi antara gas hidrogen dengan gas oksigen dalam membentuk uap air, perbandingan volumenya adalah 2:1:2
gas hidrogen + gas oksigen - > uap air
(2V liter) (V liter) (2V liter)
-
Pada reaksi antara gas nitrogen dengan gas hidrogen dalam membentuk amonia, perbandingan volumenya adalah 1:3:2
Gas nitrogen + gas hidrogen - > amonia
(V liter) (3V liter) (2V liter)
Gay Lussac menyimpulkan penemuannya sebagai Hukum Perbandingan Volume, yang berbunyi
“Bila diukur pada suhu dan tekanan yang sama, volume gas yang bereaksi dan gas hasil reaksi berbanding sebagai bilangan bulat dan sederhana.”
Contoh Soal
Dua liter gas propana, C3H8 bereaksi dengan gas oksigen menghasilkan karbon dioksida dan uap air. Tentukan:
-
volume gas O2 yang diperlukan
-
volume gas CO2 yang dihasilkan
-
volume uap air yang dihasilkan
Jawab: Persamaan reaksi setara:
C3H8(g) + 5 O2(g) - > 3 CO2(g) + 4 H2O(g)
Perbandingan volume C3H8 : O2 : CO2 : H2O = 1 : 5 : 3 : 4
-
Menghitung volume gas O2
Volume C3H8 : volume O2 = 1 : 5
Volume O2 = 5/1 × volume C3H8 = 5/1 × 2 liter = 10 liter
-
Menghitung volume gas CO2
Volume C3H8 : volume CO2 = 1 : 3
Volume CO2 = 3/1 × volume C3H8 = 3/1 × 2 liter = 6 liter
-
Menghitung volume uap air
Volume C3H8 : volume uap air = 1 : 4
Volum uap air = 4/1 × volume C3H8 = 4/1 × 2 liter = 8 liter
Jadi, volume O2 yang diperlukan adalah sebanyak 10 liter, volum gas CO2 yang dihasilkan = 6 liter, dan volum uap air yang dihasilkan = 8 liter.
5. Hukum Avogadro
Amadeo Avogadro mengemukakan bahwa partikel tidak harus berupa atom yang berdiri sendiri tetapi juga dapat sebagai gabungan dari beberapa atom yang disebut molekul. Avogadro menyempurnakan hukum perbandingan volume oleh Gay Lussac dengan megajukan hipotesis :
“Pada suhu dan tekanan yang sama, semua gas yang bervolume sama mengandung jumlah molekul yang sama pula.”
Untuk lebih memahami, perhatikan contoh berikut:
Contoh Soal
Gas nitrogen dan gas hidrogen dapat bereaksi membentuk gas amoniak (NH3) pada keadaan tekanan dan suhu yang sama. Jika 40 molekul gas nitrogen, berapa molekul gas hidrogen yang diperlukan dan berapa molekul gas NH3 yang dihasilkan?
Jawab:
Reaksi : N2(g) + 3H2(g) - > 2 NH3(g)
Perbandingan koefisien : 1 : 3 : 2
Perbandingan volum : 1 vol : 3 vol : 2 vol
Gas H2 yang diperlukan : 3/1 x 40 molekul = 120 molekul
Gas NH3 yang terjadi : 2/1 x 40 molekul = 80 molekul
Jadi, gas H2 yang diperlukan adalah 120 molekul dan NH3 yang terjadi adalah 80
molekul.
